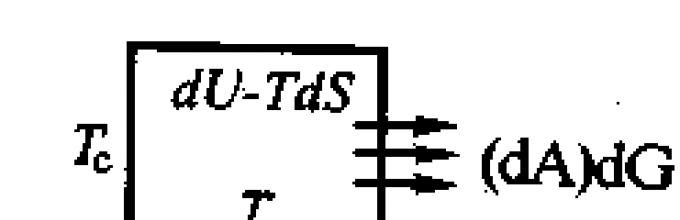Лекция 5. Энергия Гельмгольца, энергия Гиббса
5.1 Свободная энергия Гельмгольца, энергия Гиббса
5.2 Фундаментальное уравнение Гиббса и вспомогательные термодинамические функции
5.3 Изменение энергии Гиббса с температурой и давлением
Из цикла Карно известно, что η < 1 (т.е. в работу превращается не вся теплота). Поэтому даже в равновесном термодинамическом процессе всё изменение внутренней энергии нельзя превратить в работу.
Изучая природу внутренней энергии Гельмгольц пришел к выводу, что она неоднородна и состоит из двух частей:
где F –«свободная» энергия, способная к превращениям и производству полезной работы, функция (энергия) Гельмгольца, изохорно-изотермический потенциал (V и T = const), изохорный потенциал TS –«связанная» энергия, которая в работу не превращается и теряется в виде теплоты в окружающую среду. Функцию F Гельмгольц ввел в практику в 1882 году.
Значит (5.4)
где ∆ F − изменение энергии Гельмгольца.
При V=const и T=const в стандартных условиях последняя формула может быть представлена в виде:
Энергия Гельмгольца, также как внутренняя энергия и энтропия – функция состояния системы.
Критерием самопроизвольности изохорно-изотермического процесса являются неравенства ∆F V , T < 0, > 0. При ∆ F V , T > 0 и < 0 имеет место обратный процесс, в состоянии химического равновесия ∆ F V , T = 0, = 0 (- максимальная полезная работа).
Однако чаще в термодинамике приходится иметь дело с изобарно-изотермическими процессами (Р и T = const), поэтому удобнее пользоваться функцией (энергией) Гиббса.
где G Р,Т – функция Гиббса, свободная энтальпия, изобарно-изотермический потенциал, изобарный потенциал.
Энергия Гиббса – наиболее важная и часто употребляемая на практике термодинамическая функция. Введена в термодинамику Гиббсом в 1875 году.
G определяется через известные термодинамические функции.
При р,Т= const:
В стандартных условиях изменение энергии Гиббса может быть представлено следующим образом:
Критерием самопроизвольности прямого изобарно-изотермического процесса являются неравенства ∆G Р,Т < 0 и A′ > 0; при ∆ G Р,Т > 0 и A′ < 0 протекает обратный процесс, в состоянии химического равновесия ∆ G Р,Т = 0 и A′ = 0.
Энергия Гельмгольца и энергия Гиббса – функции состояния, поэтому ∆F и ∆G не зависят от пути и от характера протекания процесса, а определяются только начальным и конечным состоянием системы:
Для кругового процесса их изменение = 0:
Абсолютные значения F и G определить невозможно (т.к. они зависят от U и Н), обычно определяют величины их изменения ∆F и ∆G (кДж/моль или ккал/моль) путем измерения работы равновесного процесса. Протеканию прямого процесса в термодинамической системе способствуют: ∆Н < 0 и∆S>0, ∆G = ∆Н – T∆S, что приводит к уменьшению ∆G в выражении.
Все реальные системы неизолированные; подавляющее большинство из них, являются открытыми. Для подобных систем только с помощью энтропии нельзя охарактеризовать направление процесса. В связи с этим вводятся еще две термодинамические функции состояния - энергия Гиббса и энергия Гельмгольца, с их помощью появляется возможность определить условия самопроизвольных и равновесных процессов в изолированных системах.
Энергия Гиббса и энергия Гельмгольца
Для определения направления процесса в неизолированных системах необходимо рассматривать не только систему, но и среду, окружающую эту систему.
Энтропию как термодинамическую функцию состояния можно связать с теплотой обратимого процесса. Если бесконечно малое кол-во энергии δq предается системе обратимым способом в виде теплоты при температуре Т , в этом случае энтропия изменяется как:
δS≥ δq обр /Т (*) (где знак больше-самопроизвольный процесс, равно - равновесное состояние системы)
Используя это состношение, рассмотрим случай, когда система отдает теплоту окружающей среде (система в этом случае закрытая) при постоянном объеме. Тогда на основании равенства δq=dU (в изохорно-изотермических процессах теплота процесса равна изменению внутренней энергии) δq можно отождествлять с dU Замена δq на dU в уравнении (*) приводит к следующим результатам:
В случае потери теплоты при постоянном давлении с учетом равенства δq=dН (в изобарно-изотермических процессах теплота процесса равна изменению энтальпии) из уравнения (*) получим
Условия (4.1) и (4.2) позволяют ввести две новые термодинамические функции состояния - энергию Гельмгольца А*(ранее обозначали как F) и энергию Гиббса G, которые определяются следующим образом:
|Уравнения (4.3) и (4.4) связывают между собой пять характеристических функций состояния и дают возможность рассматривать особенности равновесных (если d А = 0 или dG =0 ) и самопроизвольных (когда d А < 0 или dG < 0 ) процессов. |Поясним смысл уравнений (4.3) и (4.4) и правых частей этих равнений при помощи рисунка.

Неизолированная система, обладающая свойствами идеального газа, имеет начальную температуру Т, а температура окружающей среды Тс, ниже начальной температуры системы, т.е. Тс<Т. Система остывает и отдает окр. среде часть своей внутренней энергии (энтальпии) в виде d А или dG , в системе остается запас энергии, соответствующей правой части уравнения 4.3 или 4.4 Если бы температура среды была равна абсолютному нолю и оставалась таковой в течение всего процесса передачи теплоты, то система тоже должна была бы остыть до темепратуры среды,т.е. до абсолютного ноля. При этом система всю свою внутреннюю энергию сообщила бы среде. Однако температура окр. среды (Тс) больше 0.
В соответствии с одной из формулировок второго начала термодинамики (невозможен самопроизвольный переход теплоты от холодного тела к горячему) система может остыть лишь до некоторой конечной температуры Т к. В этих условиях система отдает среде только часть своей внутренней энергии, которую называют свободной энергией . В изобарно-изотермическом процессе она выступает в форме энергии Гиббса dG , а в изохорно-изотермическом - энергии Гельмгольца d А.
Энергия Гиббса (энергия Гельмгольца) - это часть внутренней энергии, которую система может отдать окружающей среде. Именно поэтому ее называют "свободной". Остальная часть внутренней энергии системы, равная теплоте ее нагрева от абсолютного нуля до Т к, остается в системе и не может быть использована вне системы, в данном случае для передачи теплоты из системы в окружающую среду. Оставшаяся часть энергии как бы "заперта" в системе, поэтому ее называют связанной энергией . Связанная энергия контролируется энтропией системы и равна произведению абсолютной температуры на изменение энтропии от абсолютного нуля до абсолютной температуры системы, т. е. TdS или TΔS, что соответствует вычитаемому правой части уравнений (4.3) и (4.4).
Итак, энергия Гиббса и энергия Гельмгольца определяют ту часть теплоты (энергии), которую система может отдать; эта часть равна суммарному запасу энергии системы за вычетом той энергии, которая остается в системе
В соответствии с уравнениями (4.3) и (4.4) энергия Гиббса и энергия Гельмгольца определяются значениями энтальпии и внутренней энергией (ΔН и ΔU), с одной стороны, и энтропии ΔS- с другой, т. е. энтальпийным и энтропийным факторами . Величина ΔН(ΔU) как энтальпийный фактор возрастает по мере агрегации частиц, т. е. отражает стремление частиц объединяться. К процессам, увеличивающим ΔН , относятся сжатие газа, конденсация пара, затвердевание жидкости, ассоциация молекул, синтез молекул из атомов и т. д. Величина ΔS как энтропийный фактор характеризует противоположную тенденцию - стремление частиц к дезинтеграции, переход от порядка к беспорядку, от меньшего беспорядка к большему. К числу процессов, увеличивающих энтропию, можно отнести расширение газа, испарение жидкости, плавление, диссоциацию молекул и др., а же смешение газов, растворение, диффузию и т. д.
Термодинамическими потенциалами, или характеристическими функциями, называют термодинамические функции, которые содержат в себе всю термодинамическую информацию о системе. Наибольшее значение имеют четыре основных термодинамических потенциала:
1) внутренняя энергия U (S ,V ),
2) энтальпия H (S ,p ) = U + pV ,
3) энергия Гельмгольца F (T ,V ) = U - TS ,
4) энергия Гиббса G (T ,p ) = H - TS = F + pV .
В скобках указаны термодинамические параметры, которые получили название естественных переменных для термодинамических потенциалов. Все эти потенциалы имеют размерность энергии и все они не имеют абсолютного значения, поскольку определены с точностью до постоянной, которая равна внутренней энергии при абсолютном нуле.
Зависимость термодинамических потенциалов от их естественных переменных описывается основным уравнением термодинамики , которое объединяет первое и второе начала. Это уравнение можно записать в четырех эквивалентных формах:
dU = TdS - pdV (5.1)
dH = TdS + Vdp (5.2)
dF = - pdV - SdT (5.3)
dG = Vdp - SdT (5.4)
Эти уравнения записаны в упрощенном виде - только для закрытых систем, в которых совершается только механическая работа.
Зная любой из четырех потенциалов как функцию естественных переменных, можно с помощью основного уравнения термодинамики найти все другие термодинамические функции и параметры системы (см. пример 5-1).
Другой важный смысл термодинамических потенциалов состоит в том, что они позволяют предсказывать направление термодинамических процессов. Так, например, если процесс происходит при постоянных температуре и давлении, то неравенство, выражающее второй закон термодинамики:
эквивалентно неравенству dG p,T 0 (мы учли, что при постоянном давлении Q p = dH ), где знак равенства относится к обратимым процессам, а неравенства - к необратимым. Таким образом, при необратимых процессах, протекающих при постоянных температуре и давлении, энергия Гиббса всегда уменьшается. Минимум энергии Гиббса достигается при равновесии.
Аналогично, любой термодинамический потенциал в необратимых процессах при постоянстве естественных переменных уменьшается и достигает минимума при равновесии:
Потенциал |
Естественные |
Условие само-произвольности |
Условия |
|
S = const, V = const |
dU = 0, d 2 U > 0 |
||
|
S = const, p = const |
dH = 0, d 2 H > 0 |
||
|
T = const, V = const |
dF = 0, d 2 F > 0 |
||
|
T = const, p = const |
dG = 0, d 2 G > 0 |
Наибольшее значение в конкретных термодинамических расчетах имеют два последние потенциала - энергия Гельмгольца F и энергия Гиббса G , т.к. их естественные переменные наиболее удобны для химии. Другое (устаревшее) название этих функций - изохорно-изотермический и изобарно-изотермический потенциалы. Они имеют дополнительный физико-химический смысл. Уменьшение энергии Гельмгольца в каком-либо процессе при T = const, V = const равно максимальной механической работе, которую может совершить система в этом процессе:
F 1 - F 2 = A max (= A обр).
Таким образом, энергия F равна той части внутренней энергии (U = F + TS ), которая может превратиться в работу.
Аналогично, уменьшение энергии Гиббса в каком-либо процессе при T = const, p = const равно максимальной полезной (т.е., немеханической) работе, которую может совершить система в этом процессе:
G 1 - G 2 = A пол.
Зависимость энергии Гельмгольца (Гиббса) от объема (давления) вытекает из основного уравнения термодинамики (5.3), (5.4):
 . (5.5)
. (5.5)
Зависимость этих функций от температуры можно описать с помощью основного уравнения термодинамики:
![]() (5.6)
(5.6)
или с помощью уравнения Гиббса-Гельмгольца:
![]() (5.7)
(5.7)
Расчет изменения функций F и G в химических реакциях можно проводить разными способами. Рассмотрим два из них на примере энергии Гиббса.
1) По определению, G = H - TS . Если продукты реакции и исходные вещества находятся при одинаковой температуре, то стандартное изменение энергии Гиббса в химической реакции равно:
2) Аналогично тепловому эффекту реакции, изменение энергии Гиббса можно рассчитать, используя энергии Гиббса образования веществ:
В термодинамических таблицах обычно приводят абсолютные энтропии и значения термодинамических функций образования соединений из простых веществ при температуре 298 К и давлении 1 бар (стандартное состояние). Для расчета r G и r F при других условиях используют соотношения (5.5) - (5.7).
Все термодинамические потенциалы являются функциями состояния. Это свойство позволяет найти некоторые полезные соотношения между частными производными, которые называют соотношениями Максвелла .
Рассмотрим выражение (5.1) для внутренней энергии. Т.к. dU - полный дифференциал, частные производные внутренней энергии по естественным переменным равны:
![]()
Если продифференцировать первое тождество по объему, а второе - по энтропии, то получатся перекрестные вторые частные производные внутренней энергии, которые равны друг другу:
![]() (5.10)
(5.10)
Три другие соотношения получаются при перекрестном дифференцировании уравнений (5.2) - (5.4).
 (5.11)
(5.11)
![]() (5.12)
(5.12)
 (5.13)
(5.13)
ПРИМЕРЫ
Пример 5-1. Внутренняя энергия некоторой системы известна как функция энтропии и объема, U (S ,V ). Найдите температуру и теплоемкость этой системы.
Решение . Из основного уравнения термодинамики (5.1) следует, что температура - это частная производная внутренней энергии по энтропии:
Изохорная теплоемкость определяет скорость изменения энтропии с температурой:
Воспользовавшись свойствами частных производных, можно выразить производную энтропии по температуре через вторую производную внутренней энергии:
 .
.
Пример 5-2. Используя основное уравнение термодинамики, найдите зависимость энтальпии от давления при постоянной температуре: а) для произвольной системы; б) для идеального газа.
Решение . а) Если основное уравнение в форме (5.2) поделить на dp при постоянной температуре, получим:
 .
.
Производную энтропии по давлению можно выразить с помощью соотношения Максвелла для энергии Гиббса (5.13):
 .
.
б) Для идеального газа V (T ) = nRT / p . Подставляя эту функцию в последнее тождество, получим:
 .
.
Энтальпия идеального газа не зависит от давления.
Пример 5-3. Выразите производные и через другие термодинамические параметры.
Решение . Основное уравнение термодинамики (5.1) можно переписать в виде:
![]() ,
,
представив энтропию как функцию внутренней энергии и объема. Коэффициенты при dU и dV равны соответствующим частным производным:
![]() .
.
Пример 5-4. Два моля гелия (идеальный газ, мольная теплоемкость C p = 5/2 R ) нагревают от 100 о С до 200 о С при p = 1 атм. Вычислите изменение энергии Гиббса в этом процессе, если известно значение энтропии гелия, = 131.7 Дж/(моль. К). Можно ли считать этот процесс самопроизвольным?
Решение . Изменение энергии Гиббса при нагревании от 373 до 473 К можно найти, проинтегрировав частную производную по температуре (5.6):
 .
.
Зависимость энтропии от температуры при постоянном давлении определяется изобарной темлоемкостью:
Интегрирование этого выражения от 373 К до T дает:
Подставляя это выражение в интеграл от энтропии, находим:

Процесс нагревания не обязан быть самопроизвольным, т.к. уменьшение энергии Гиббса служит критерием самопроизвольного протекания процесса только при T = const и p = const.
Ответ. G = -26850 Дж.
Пример 5-5. Рассчитайте изменение энергии Гиббса в реакции
CO + ЅO 2 = CO 2
при температуре 500 K и парциальных давлениях 3 бар. Будет ли эта реакция самопроизвольной при данных условиях? Газы считать идеальными. Необходимые данные возьмите из справочника.
Решение . Термодинамические данные при температуре 298 К и стандартном давлении 1 бар сведем в таблицу:
Вещество |
Энтальпия образования |
Энтропия |
Теплоемкость |
КДж/моль |
Дж/(моль. К) |
Дж/(моль. К) |
|
CO + ЅO 2 = |
Примем, что C p = const. Изменения термодинамических функций в результате реакции рассчитаны как разность функций реагентов и продуктов:
f = f (CO 2) - f (CO) - Ѕ f (O 2).
Стандартный тепловой эффект реакции при 500 К можно рассчитать по уравнению Кирхгофа в интегральной форме (3.8):

Стандартное изменение энтропии в реакции при 500 К можно рассчитать по формуле (4.9):

Стандартное изменение энергии Гиббса при 500 К:
Для расчета изменения энергии Гиббса при парциальных давлениях 3 атм необходимо проинтегрировать формулу (5.5) и использовать условие идеальности газов (V = n RT / p , n - изменение числа молей газов в реакции):

Эта реакция может протекать самопроизвольно при данных условиях.
Ответ . G = -242.5 кДж/моль.
ЗАДАЧИ
5-1. Выразите внутреннюю энергию как функцию переменных G , T , p .
5-2. Используя основное уравнение термодинамики, найдите зависимость внутренней энергии от объема при постоянной температуре: а) для произвольной системы; б) для идеального газа.
5-3. Известно, что внутренняя энергия некоторого вещества не зависит от его объема. Как зависит давление вещества от температуры? Ответ обоснуйте.
5-4. Выразите производные и через другие термодинамические параметры и функции.
5-5. Напишите выражение для бесконечно малого изменения энтропии как функции внутренней энергии и объема. Найдите частные производные энтропии по этим переменным и составьте соответствующее уравнение Максвелла.
5-6. Для некоторого вещества известно уравнение состояния p (V , T ). Как изменяется теплоемкость C v с изменением объема? Решите задачу: а) в общем виде; б) для какого-либо конкретного уравнения состояния (кроме идеального газа).
5-7. Докажите тождество:  .
.
5-8. Энергия Гельмгольца одного моля некоторого вещества записывается следующим образом:
F = a + T (b - c - b ln T - d ln V ),
где a , b , c , d - константы. Найдите давление, энтропию и теплоемкость C V этого тела. Дайте физическую интерпретацию константам a , b , d .
5-9. Нарисуйте график зависимости энергии Гиббса индивидуального вещества от температуры в интервале от 0 до T > T кип.
5-10. Для некоторой системы известна энергия Гиббса:
G(T ,p ) = aT (1-lnT ) + RT lnp - TS 0 + U 0 ,
где a , R , S 0 , U 0 - постоянные. Найдите уравнение состояния p (V ,T ) и зависимость U (V ,T ) для этой системы.
5-11. Зависимость мольной энергии Гельмгольца некоторой системы от температуры и объема имеет вид:
где a , b , c , d - константы. Выведите уравнение состояния p (V ,T ) для этой системы. Найдите зависимость внутренней энергии от объема и температуры U (V ,T ). Каков физический смысл постоянных a , b , c ?
5-12. Найдите зависимость мольной внутренней энергии от объема для термодинамической системы, которая описывается уравнением состояния (для одного моля)
![]() ,
,
где B (T ) - известная функция температуры.
5-13. Для некоторого вещества зависимость теплоемкости от температуры имеет вид: C V = aT 3 при температуре 0 - 10 К. Найдите зависимость энергии Гельмгольца, энтропии и внутренней энергии от температуры в этом диапазоне.
5-14. Для некоторого вещества зависимость внутренней энергии от температуры имеет вид: U = aT 4 + U 0 при температуре 0 - 10 К. Найдите зависимость энергии Гельмгольца, энтропии и теплоемкости C V от температуры в этом диапазоне.
5-15. Выведите соотношение между теплоемкостями:
 .
.
5-16. Исходя из тождества ![]() , докажите тождество:
, докажите тождество:
 .
.
5-17. Один моль газа Ван-дер-Ваальса изотермически расширяется от объема V 1 до объема V 2 при температуре T . Найдите U , H , S , F и G для этого процесса.
Для характеристики процессов, протекающих в закрытых системах, введем новые термодинамические функции состояния: изобарно-изотермический потенциал (свободная энергия Гиббса G) и изохорно-изотермический потенциал (свободная энергия Гельмгольца F).
Для закрытой системы, в которой осуществляется равновесный процесс при постоянных температуре и объеме, выразим работу данного процесса. Которую обозначим А max (поскольку работа процесса, проводимого равновесно, максимальна):
A max =T∆S-∆U
Введем функцию F=U-TS-изохорно-изотермический потенциал, определяющий направление и предел самопроизвольного протекания процесса в закрытой системе, находящейся в изохорно-изотермических условиях и получим:
∆F=∆U-T∆S
Изменение энергии Гельмгольца определяется только начальным и конечным состоянием системы и не зависит от характера процесса, поскольку оно определяется двумя функциями состояния: U и S. Напомним, что от способа проведения процесса при переходе системы из начального в конечное состояние может зависеть величина полученной или затраченной работы, но не изменение функции.
Закрытую систему, находящуюся в изобарно- изотермических условиях, характеризует изобарно-изотермический потенциал G:
G=U+PV-TS=H-TS
∆G=∆H-T∆S
Дифференциал энергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных - через давление p и температуру T:
Для системы с переменным числом частиц этот дифференциал записывается так:
Здесь - химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
Анализ уравнения ∆G=∆H-T∆S позволяет установить, какой из факторов, составляющих энергию Гиббса, ответственен за направление протекания химической реакции, энтальпийный (ΔH) или энтропийный (ΔS · T).
Если ΔH < 0 и ΔS > 0, то всегда ΔG < 0 и реакция возможна при любой температуре.
Если ΔH > 0 и ΔS < 0, то всегда ΔG > 0, и реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях.
В остальных случаях (ΔH < 0, ΔS < 0 и ΔH > 0, ΔS > 0) знак ΔG зависит от соотношения ΔH и TΔS. Реакция возможна, если она сопровождается уменьшением изобарного потенциала; при комнатной температуре, когда значение T невелико, значение TΔS также невелико, и обычно изменение энтальпии больше TΔS. Поэтому большинство реакций, протекающих при комнатной температуре, экзотермичны. Чем выше температура, тем больше TΔS, и даже эндотермические реакции становятся осуществляемыми.
Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Изменение энергии Гиббса не зависит от пути процесса, следовательно можно получать разные неизвестные значения энергий Гиббса образования из уравнений, в которых с одной стороны записаны суммы энергий продуктов реакции, а с другой - суммы энергий исходных веществ.
При пользовании значениями стандартной энергии Гиббса критерием принципиальной возможности процесса в нестандартных условиях принимается условие ΔG° < 0, а критерием принципиальной невозможности - условие ΔG° > 0. В то же время, если стандартная энергия Гиббса равна нулю, это не означает, что в реальных условиях (отличных от стандартных) система будет в равновесии.
Условия самопроизвольного протекания процессов в закрытых системах:
∆G<0, dG<0;
∆F<0,dF<0.
Константа равновесия
Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации С, парциальные давления P или мольные доли X реагирующих веществ. Для некоторой реакции
соответствующие константы равновесия выражаются следующим образом:
Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от природы реагирующих веществ и температуры. Выражение для константы равновесия для элементарной обратимой реакции может быть выведено из кинетических представлений.
Приняв, что V 1 = V 2 , можно записать:
Таким образом, константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л.
Энергия Гельмгольца (изохорно-изотермический потенциал) является характеристической функцией, если независимыми переменными выбраны объем и температура . Полный дифференциал энергии Гельмгольца для простых систем записывается в виде:
а в случае обратимых процессов как
Полагая V = const
Функция А = f (T ) при V = const является убывающей, а кривая зависимости энергии Гельмгольца от температуры при постоянном объеме обращена выпуклостью вверх (рис. 4.3). Мерой убыли энергии Гельмгольца при повышении температуры вещества является энтропия .
Полагая Т = const , из уравнения (4.57) получаем
Функция А = f (V ) при T = const также является убывающей, но кривая зависимости энергии Гельмгольца от объема при постоянной температуре обращена выпуклостью вниз (рис. 4.3).
Рис.4.3. Зависимость энергии Гельмгольца от температуры и объема.
При протекании обратимых процессов в сложных системах, способных выполнять кроме работы расширения и другие виды работы (полезную работу), справедливо:
Если процесс изотермический (Т = const ), то
Итак, в обратимом изотермическом процессе убыль энергии Гельмгольца равна максимальной (полной) работе, производимой системой . В этом заключается основной смысл введения новой функции А : через изменение функции состояния в изотермических условиях можно определить максимальную работу в обратимом процессе.
Если обратимый процесс протекает в изохорно-изотермических условиях , то
В обратимом изохорно-изотермическом процессе убыль энергии Гельмгольца равна максимальной полезной работе .
Рассмотрим систему и окружающую среду, которые находятся в тепловом равновесии: Т сист. = Т ср. . Пусть в системе протекает процесс, в результате которого в окружающую среду переходит количество теплоты δQ cр. . Тогда общее изменение энтропии dS общ (ее называют изменением энтропии вселенной ) равно:
Поскольку теплота уходит из системы, то δQ cр. = –δQ сист. , поэтому
Но dS общ. положительно для любого самопроизвольного (необратимого) процесса и равно нулю при равновесии. Следовательно,
Значение неравенства (4.63) состоит в том, что оно выражает критерий самопроизвольного изменения только через свойства системы . Если система теряет теплоту при постоянном объеме, то
δQ V = dU ,
поэтому соотношение (4.63) принимает вид:
В последнем соотношении нижний индекс опущен, поскольку все величины относятся к системе. Следует понимать, что dS – это изменение энтропии системы, а ‑dU /T – изменение энтропии среды: суммарная энтропия стремится к максимуму.
Поскольку в конечном итоге рассматривается изохорно-изотерми-ческий процесс, то
Следовательно, при протекании процессов в изохорно-изотермических условиях должно выполняться неравенство
где знак равенства относится к обратимым процессам, а знак неравенства – к необратимым.
Если в обратимом процессе энтропия системы увеличивается, то максимальная работа больше, чем –ΔU , так как T ΔS положительно. Система не изолирована и поэтому в нее может поступать теплота, служащая источником энергии для производства работы. Если же ΔS отрицательно, то теплота должна выделяться из системы, чтобы привести к общему увеличению энтропии (энтропии вселенной). Поэтому не все изменение внутренней энергии может перейти в работу и W max < (–ΔU ).